Antibiogramme/Antifongigramme
Principe
L’antibiogramme est un test de diagnostic in vitro, permettant de déterminer le niveau de susceptibilité d’une bactérie à un antibiotique donné ou à un antifongique dans le cas d’un champignon.
La susceptibilité aux antibiotiques / antifongiques est donnée par la CMI (Concentration minimale inhibitrice) C’est à dire la concentration la plus faible pour laquelle la croissance bactérienne/ fongique est inhibée à au moins 50% par rapport à la croissance sans drogue.
On peut également déterminer la CMB (concentration minimale bactéricide), la concentration la plus faible capable d’entraîner la mort d’au moins 99,99 % des bactéries / champignons. La CMI sera ensuite interprétée selon des critères internationaux (breakpoints) afin de déterminer si la souche est sensible (CMI inférieure au breakpoint) ou résistance (CMI supérieure au breakpoint) à la drogue testée. l’antibiogramme ou l’antifongigramme sont des outils d’aide à la décision thérapeutique, permettant de choisir l’antibiotique/antifongique le plus efficace contre un pathogène.
Dans la suite de l’article, nous allons nous focaliser sur l’antibiogramme, le principe est le même pour la réalisation de l’antifongigramme.
Techniques/Méthodes :
En principe, suite à l’identification d’un pathogène dans un prélèvement clinique, le biologiste décide de la pertinence d’effectuer un test de sensibilité. Si c’est le cas, la souche à tester est isolée afin de partir d’une culture pure pour effectuer l’antibiogramme.
Il existe différentes méthodes pour réaliser un antibiogramme. Les plus utilisées sont :
- La méthode des disques de diffusion: Une boîte de Pétri contenant un milieu de culture solide est ensemencée de culture bactérienne. Les bactéries sont alors cultivées en présence d’un ou plusieurs antibiotiques disposés sur un disque de papier buvard à une concentration standard. Après quelques heures d’incubation, l’antibiotique présent dans le disque aura diffusé dans la gélose créenat un gradient. On peut alors observer un diamètre d’inhibition du pathogène. Plus ce diamètre est important, plus le pathogène sera sensible à l’antibiotique. On mesure ce diamètre et on le confronte aux critères d’interprétation établis par les consortiums internationaux.


- La Microdilution: “Microdilution successive en milieu liquide : Cette méthode est considérée comme le gold-standard. Elle consiste à mettre un inoculum bactérien standardisé (10E+06 CFU/ml) au contact de concentrations croissantes d’antibiotiques selon une progression géométrique de raison 2 (ex. 0.25, 0.5, 1, 2, 4, 8, 16µg/ml, etc.). Après 18h à 24h d’incubation à 37°C, la CMI correspond à la concentration à laquelle l’inhibition de la croissance bactérienne est visible à l’œil nu (absence de turbidité dans le tube).”
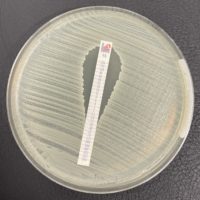
- E-test: C’est une technique permettant de déterminer la CMI en utilisant une bandelette imprégnée d’un gradient continu de l’antibiotique à tester. “Ce gradient couvre une zone qui, en fonction de l’antibiotique, va de 0,016 à 256 mg/L ou de 0,002 à 32 mg/L.” La lecture se fait après une incubation de 18 à 24h, qui permet la diffusion de la drogue dans la gélose et la croissance de la bactérie. La zone d’inhibition forme cette fois une ellipse autours de la bandelette. La CMI est définie par le point d’intersection entre la bandelette et l’extrémité de l’ellipse.
Indications et Applications
Les antibiogrammes permettent de classer les bactéries selon leur sensibilité à un antibiotique particulier, ou encore d’identifier certaines souches selon leur résistance à une famille d’antibiotiques. le résultat de l’antibiogramme et son interprétation guide le médecin dans le choix de l’antibiothérapie afin de limiter les risques de résistance aux antibiotiques. C’est aussi un outil d’aide aux études épidémiologiques permettant de suivre l’évolution des résistances bactériennes.
Avantages
- Faible coût des réactifs
- Le contrôle se fait visuellement⇒ possibilité de détecter des résultats aberrants
- autonomie du biologiste dans le choix des antibiotiques à tester
Inconvénients
- Durée d’incubation relativement longue (plus d’une dizaine d’heures)
- Résultats qualitatifs
- Test in vitro, Les résultats ne sont pas toujours directement transposables chez le patient.
- Variabilité inter-opérateur
- Traçabilité des résultats difficile
- Erreurs de lecture possibles
Perspectives/futur
Les premiers systèmes automatisés pour la réalisation de l’antibiogramme sont apparus au milieu des années 70 (il n’existe toujours pas d’automate pour les antifongigrammes). Mais hormis la lecture le reste des opérations se fait toujours manuellement. Actuellement, il existe des automates qui permettent d’effectuer toutes les étapes de la réception des prélèvements à la lecture du résultat en passant par l’ensemencement et l’incubation, l’identification du germe, la réalisation de l’antibiogramme et sa lecture. L’automatisation a l’avantage de diminuer la variabilité inter-opérateurs, les erreurs (oubli d’ensemencement, erreur d’identité, etc.), et offre une traçabilité complète. Permettant ainsi un gain de temps considérable et une prise de décision plus rapide et plus sûre concernant le traitement à mettre en place.
D’autres méthodes permettant de déterminer la sensibilité à un antibiotique existent (liste non exhaustive) et sont en développement:
- La Biologie Moléculaire : Les tests PCR quantitatifs permettent de détecter les gènes de résistance connus.
- Le Maldi-ToF MS : permet de détecter la présence ou non de produits de dégradation de l’antibiotique par l’agent pathogène, ou la présence de protéines directement impliquées dans la résistance.
